Электрогальваническая характеристика тканей полости рта у больных с кистами челюстей
Несъемные металлические протезы находят широкое применение в стоматологии для замещения дефектов отдельных зубов и зубных рядов. Для изготовления несъемных зубных протезов наиболее часто применяют неблагородные группы металлов и их сплавы (рис. 1). Разнородные металлы, находясь в полости рта человека, при контакте с электролитом (слюной) отдают положительно заряженные ионы в раствор. Вследствие этого на металлическом протезе, окруженном слюной, возникает электрический заряд, а между разнородными металлами – разность электрогальванических потенциалов, т. е. образуется гальванический элемент [1, 2, 3, 4, 5, 6]. В полости рта появляются оксиды металлов, которые неблагоприятно воздействуют на слизистую оболочку и организм пациента. Одной из причин коррозии также могут служить разность гальванических потенциалов, сдвиг рН слюны в кислую сторону и другие факторы. Возникающие при этом в полости рта гальванические токи приводят к развитию заболеваний, которые в стоматологической литературе нередко обозначаются одним универсальным термином «непереносимость металлических включений в полости рта» (гальваноз).
Отмечено, что в последние годы происходит рост количества больных с доброкачественными опухолями и опухолеподобными образованиями челюстно-лицевой области. Следует обратить внимание на тот факт, что некоторые доброкачественные опухоли и опухолеподобные образования челюстей появляются через некоторое время (полгода – год – несколько лет) после изготовления пациентам несъемных металлических зубных протезов. С большим сожалением необходимо отметить, что для изготовления несъемных зубных протезов наиболее часто используются сплавы металлов, которые в 10–30 % случаев приводят к развитию симптомокомплекса «непереносимости сплавов металлических включений» [1, 2, 3, 4, 5, 6, 13, 14, 15]. Этиологическая и патогенетическая роль «непереносимости сплавов металлов» в возникновении и развитии кист челюстей ранее не выяснялась. В литературе сведения об этом отсутствуют. В стоматологической литературе уже было доказано, что электрогальваническое действие сплавов металлических включений в полости рта приводит к созданию предрасполагающего фона для появления заболеваний слизистой оболочки полости рта – электрогальванических язв, лейкоплакий [9]. На этом фоне могут возникать доброкачественные [7, 8, 10, 11, 12] и злокачественные опухоли [9].
Цель исследования – установить выраженность изменений потенциометрических показателей у больных с кистами челюстей и одновременным наличием в полости рта металлических включений, а также определить патогенетическую роль этих изменений в возникновении данных опухолеподобных образований.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Были обследованы больные с опухолеподобными образованиями челюстей с наличием в полости рта металлических включений, а именно: 40 – с кистами челюстей (первая группа наблюдения). Контролем служили 27 человек с наличием в полости рта металлических включений (мостовидных протезов, металлических коронок и пломб), но без наличия у них кист челюстных костей.
Всем обследуемым при госпитализации были проведены общеклинические методы обследования, которые включали: сбор анамнеза, осмотр, пальпацию, рентгенографию челюстей в разных проекциях, компьютерную томографию, клинические анализы крови.
Определение рН ротовой жидкости проводили при помощи серийного цифрового рН-метра-милливольтметра РН-150-М, стеклянного измерительного электрода и хлорсеребряного электрода сравнения ЭВЛ-1М2 в соответствии с инструкцией по эксплуатации прибора. Слюну брали утром натощак и регистрировали значения рН через 3 мин согласно инструкции к аппарату.
У всех обследуемых в полости рта имелись металлические включения (мостовидные протезы, коронки и пломбы), и поэтому мы измеряли величины гальванических потенциалов, т. е. устанавливали величину электрогальванического потенциала между металлическими включениями. Для проведения потенциометрического метода обследования нами был использован автоматический цифровой потенциометр «Pitterling Electronic» с 32-мя ячейками памяти для воспроизведения результатов и парой электродов измерения из хромоникелевого сплава во фторопластовых держателях (производство Германии). Прибор автоматически определяет разность потенциалов в диапазоне от 0 до 999 мВ, силу тока в диапазоне от 0 до 99 мкА и электрическую проводимость ротовой жидкости в полости рта в микросименсах (мкСм). В установленном режиме измерения (через 10–20 секунд после включения прибора) при контакте одного из электродов с металлической поверхностью (поверхностью зуба), а второго со слизистой оболочкой в подъязычной области на дисплее высвечиваются цифровые значения разности потенциалов, силы тока и электрической проводимости ротовой жидкости.
Контактную термометрию на слизистой оболочке альвеолярного отростка челюсти мы проводили электротермометром ТПЭМ-1, имеющим точечные термопары (датчики) с диапазоном измерения от 16 до 42°С. Точность регистрации – 0,2°С. Время контакта датчика со слизистой оболочкой полости рта – 20 секунд, интервалы между повторными обследованиями составляли от 2-х до 5-ти секунд. Прикосновение датчиком осуществляли приблизительно с одной и той же силой давления. Местную температуру измеряли трижды и вычисляли среднее арифметическое. Температуру мы измеряли на исследуемой и здоровой стороне. Согласно рекомендациям А.А. Тимофеева (2002), в основе проводимой контактной термометрии лежит не измерение абсолютных температур над патологическим очагом, а выявление разницы температуры (термоасимметрия) на симметричных участках (DТ). Контролем всегда служила термоасимметрия (DТ) на симметричных участках, выявленная у практически здоровых людей одинакового возраста и пола.
Индексную оценку состояния тканей пародонта проводили на противоположных патологическому очагу (кисте) участках челюстей по следующим показателям: гигиеническому индексу, пробам Шиллера-Писарева, папиллярно-маргинально-альвеолярному индексу (РМА).
Гигиенический индекс определяли по индексу Грина-Вермильона (Green-Vermilion, 1964). Использовали упрощенный индекс гигиены полости рта (OHI-S), который заключается в визуальной оценке площади поверхности зуба, покрытой налетом и/или назубным камнем, не требует использования специальных красителей. Значения зубного налета следующие: 0 – нет налета, 1 – 1/3 коронки или любое количество плотного пигментированного налета, 2 – на 2/3 коронки, 3 – более 2/3 коронки. Значения назубного камня: 0 – нет, 1 – наддесневой камень на 1/3 коронки, 2 – наддесневой камень на 2/3 коронки и/или поддесневой камень в виде отдельных конгломератов, 3 – наддесневой камень более 2/3 коронки или поддесневой камень, окружающий пришеечную часть зуба.
Оценку проводили по схеме Луцкой И.К. и соавт. (2001), которая представлена в табл. 1.
Для выявления наличия воспалительного процесса слизистой оболочки альвеолярных отростков проводили пробу Шиллера-Писарева. Слизистую оболочку альвеолярных отростков обрабатывали раствором Люголя. Интенсивность окрашивания оценивали в баллах: 1 балл – окрашивания нет, 2 балла – слабое окрашивание, 3 балла – интенсивное окрашивание. Вычисляли среднее значение для показателей верхней и нижней челюсти. Для объективизации пробу Шиллера-Писарева можно выражать в цифрах (баллах), оценивая окраску сосочков в 2 балла, окраску края десны в 4 балла и окраску альвеолярной десны в 8 баллов. Полученную общую сумму баллов затем следует разделить на количество зубов, в области которых проведено исследование (обычно 6):
Таким образом, определяют цифровое значение пробы Шиллера-Писарева (йодное число Свракова) в баллах.
Оценка значений йодного числа Свракова:
слабо выраженный процесс воспаления – до 2,3 балла;
умеренно выраженный процесс воспаления – 2,67–5,0 баллов;
интенсивный процесс воспаления – 5,33–8,0 баллов.
Для оценки тяжести гингивита (а в последующем и регистрации динамики процесса) использовали папиллярно-маргинально-альвеолярный индекс (РМА).
Папиллярно-маргинально-альвеолярный индекс (Масслер М., Шур Д., 1948), позволяет судить о протяженности и тяжести гингивита. Индекс может быть выражен в абсолютных цифрах или в процентах (Парма С., 1960). Оценку воспалительного процесса проводят следующим образом: воспаление сосочка – 1 балл; воспаление края десны – 2 балла; воспаление альвеолярной десны – 3 балла. Оценивали состояние десны у каждого зуба. Индекс вычисляли по следующей формуле:
где цифра «3» – это коэффициент усреднения.
Оценочные критерии индекса РМА: 30 % и менее – легкая степень тяжести гингивита; 31–60 % – средняя степень тяжести; 61 % и выше – тяжелая степень.
Верификацию (уточнение) диагноза проводили после оперативного удаления опухолевидного образования (кисты) и патогистологического исследования.
Полученные нами цифровые данные лабораторных обследований обрабатывали общепринятым вариационно-статистическим методом с использованием персонального компьютера и пакета статистических программ SPSS 11.0 for Windows и Microsoft Excel 2000. Достоверность результатов обследования оценивали по критериям Стьюдента. Различия считались достоверными при р < 0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
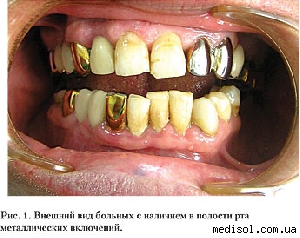
Обследовано 40 больных с радикулярными кистами челюстей в возрасте от 23-х до 57-и лет. У всех обследуемых (100 %) с одонтогенными кистами были обнаружены несъемные металлические включения в полости рта (металлические коронки и мостовидные протезы). Металлические включения всегда располагались на зубах, которые являлись «причинными» в развитии кист челюстных костей. Металлические конструкции из нержавеющей стали были выявлены у 12-ти человек (30,0 %), хромокобальтового (хромоникелевого) сплава – у 15 чел. (37,5 %), защитное нитрид-титановое покрытие – у 13 чел. (32,5 %). Цельнолитые металлические конструкции обнаружены у 17 чел. (42,5 %), а штампованно-паяные – у 23 чел. (57,5 %).
При визуальном осмотре поверхности имеющихся несъемных металлических конструкций (зубных протезов), которые находились в области патологического очага, выявили: надломы в местах пайки – у 10 чел. (25,0 %), трещины или полное нарушение целостности (перелом) несъемной конструкции зубных протезов в месте пайки – у 3 чел. (7,5 %), темная окисная пленка в месте расположения припоя – у 14 чел. (35,0 %), участки коррозийных поражений – у 15 чел. (37,5 %), неравномерное распределение по поверхности зубного протеза металлозащитного покрытия (МЗП) из нитрида титана, т. е. «лысые» зоны – у 16 чел. (40,0 %). У 18-ти обследуемых (45,0 %) данные клинические симптомы сочетались между собой, т. е. было два и даже три этих нарушения (изменения со стороны несъемного зубного протеза). Неповрежденные металлические зубные протезы в данной группе обследуемых были обнаружены только у 2-х человек (5,0 %).
Клинически радикулярные кисты располагались как в верхнечелюстной, так и в нижнечелюстной кости (рис. 2). У 8-и больных (20,0 %) киста развивалась без выраженной клинической симптоматики. Жалобы больных сводились к подвижности зубов у 18-ти больных (45,0 %) и наличию асимметрии лица у 7 обследуемых (17,5 %).
Как ранее было сказано, жалобы больных отсутствовали у 8 чел. (20,0 %), т. е. протекали бессимптомно, а ее обнаружение – это случайная находка при рентгенографии зубов во время обращения к врачу-стоматологу. В других случаях (у 32 чел., т. е. в 80,0 %) жалобы сводились к наличию деформации челюсти или свищей на альвеолярном отростке. При осмотре полости рта определялась сглаженность или выбухание округлой формы передней стенки челюсти в области переходной складки. Пальпация деформации была безболезненной, границы выбухания четкие. При пальпации у 6 чел. (15,0 %) имелся симптом «пергаментного хруста» (симптом Дюпюитрена). Сдавление сосудисто-нервного пучка на нижней челюсти вызывало симптом Венсана (парестезию нижней губы) у 5 чел. (12,5 %). При прорастании кисты, развивающейся от центральных резцов верхней челюсти в сторону носовой полости, можно было обнаружить валик Гербера – выпячивание в нижнем носовом ходу, которое выявлялось при риноскопии.
При нагноении кист у 7-и человек (в 17,5 % случаев) ухудшалось общее состояние, появлялись симптомы интоксикации и другие признаки воспалительного процесса: повышение температуры тела, боль, припухлость, гиперемия слизистой оболочки в области кисты. Возникали периоститы, регионарные лимфадениты, свищи, гайморит.
Рентгенологическая картина кисты характеризовалась наличием гомогенного участка разрежения костной ткани округлой формы с четкими границами – ободком кортикальной костной ткани (рис. 2). Рентгенологически менее четкие границы кисты были только при наличии (в анамнезе) периодических обострений воспалительных явлений в области опухолевидного образования. В кистозную полость обращен корень причинного зуба, периодонтальная щель его со стороны кисты не контурировалась. Корень причинного зуба, находящегося в полости кисты, не подвергался рассасыванию. По границам кисты иногда прослеживался ободок склерозированной кости.
Электрогальванические измерения проведены у 29-ти больных с радикулярными кистами челюстей и наличием в полости рта металлических включений. Величины электрогальванических потенциалов между металлическими включениями в полости рта (коронками и мостовидными протезами) находились в пределах от 140 до 320 мВ (табл. 2). Величины потенциалов от 140 до 190 мВ были выявлены у 9 из 29-ти обследуемых (31,0 %). Величины гальванических потенциалов от 200 до 290 мВ – у 17-ти больных (58,6 %), от 300 до 320 мВ – у 3-х больных (10,4 %).
Величина тока между металлическими протезами полости рта составила от 8 до 27 мкА (табл. 2). Величина силы тока менее 10 мкА выявлена у 3-х из 29-ти обследуемых (10,4 %), от 10 до 19 мкА – у 20 больных (68,9 %), от 20 до 27 мкА – у 6-ти больных (20,7 %).
Величина электрической проводимости ротовой жидкости у обследуемых больных находилась в пределах от 12 до 28 мкСм (табл. 2). Величина электрической проводимости ротовой жидкости менее 10 мкСм не была обнаружена, величины от 10 до 19 мкСм – у 16-ти больных (55,2 %), от 20 до 28 мкСм – у 13 больных (44,8 %).
На основании анализа таблицы 2 было установлено, что у больных с радикулярными кистами челюстей при нахождении в полости рта несъемных металлических включений, достоверно (р < 0,001) повышались уровни потенциометрических показателей (разности потенциалов – 229,7±9,6 мВ, силы тока – до 15,7±1,0 мкА и электрической проводимости ротовой жидкости – 19,9±0,8 мкСм). Следует отметить, что множественные радикулярные кисты челюстей, т. е. более двух кист у одного больного, выявлялись только у обследуемых с максимально повышенным (для этой группы) уровнем потенциометрических показателей, т. е. при разности потенциалов более 150 мВ, силы тока более 10 мкА и электрической проводимости ротовой жидкости более 10 мкСм.
Величины рН ротовой жидкости определены у 29-ти обследуемых. Величины рН ротовой жидкости находились в пределах от 5,6 до 7,4 ед. Величина рН ротовой жидкости менее 6,0 ед. выявлена у 10 больных (34,5 %), от 6,0 до 6,9 ед. – у 15-ти больных (51,7 %), а от 7,0 до 7,4 ед. – у 4-х больных (13,8 %). Обследование данной группы больных (29 чел.), т. е. обследуемых с радикулярными кистами челюстей, установлено среднестатистическое значение величин рН ротовой жидкости 6,3±0,1 ед. (с колебаниями от 5,6 до 7,4). В контрольной группе (у 22-х здоровых лиц) показатели рН ротовой жидкости были 7,2±0,2 ед. (с колебаниями от 6,1 до 8,2). Таким образом, было выявлено достоверное снижение рН ротовой жидкости у больных с радикулярными кистами челюстей (р < 0,01) по сравнению с контрольной группой наблюдения (здоровыми людьми).
Измерение термоасимметрии слизистой оболочки альвеолярных отростков челюстей проведено у 29-ти обследуемых первой группы наблюдения. Измерение (при госпитализации) термоасимметрии слизистой оболочки альвеолярных отростков верхней и нижней челюстей (на стороне расположения радикулярных кист и здоровой стороне) показало, что разница температур, т. е. термоасимметрия, достоверно (р < 0,05) отличалась от здоровой стороны и составляла 1,4±0,1°С (на верхней челюсти) и 1,3±0,1°С (на нижней челюсти). Разница температур (термоасимметрия) между центром радикулярной кисты и здоровой стороной составляла 1,6±0,2°С. Эта термоасимметрия чаще наблюдалась в тех участках, где имелось обострение воспалительного процесса, т. е. воспалительно-измененная (гиперемированная и отечная) слизистая оболочка. В тех местах, где имелось нагноение радикулярных кист челюстей, воспалительные явления были более активными, и термоасимметрия достигала 2,0°С и более (табл. 3 и 4).
Согласно таблицам 3 и 4, установлено, что наибольшие достоверные показатели термоасимметрии слизистой оболочки альвеолярного отростка (р < 0,01) наблюдались в области патологического очага (радикулярной кисты).
Измерение (на следующий день после проведенной операции) термоасимметрии слизистой оболочки альвеолярных отростков верхней и нижней челюстей (на стороне операции и здоровой стороне) показало, что разница температур, т. е. термоасимметрия, достоверно (р < 0,05) отличалась от здоровой стороны и составляла 1,2±0,1°С (на верхней челюсти) и 1,1±0,1°С (на нижней челюсти). Через два дня после проведенной операции разница температур, т. е. термоасимметрия, достоверно (р > 0,05) не отличалась от здоровой стороны и составляла 0,7±0,1°С (на верхней челюсти) и 0,6±0,1°С (на нижней челюсти). Полученные данные термоасимметрии после операции приведены в таблице 5.
В динамике лечения изучаемый показатель нормализовался. Чем эффективнее проводимая терапия, тем быстрее происходит нормализация термоасимметрии. На основании полученных данных можно утверждать, что показатели термоасимметрии слизистой оболочки альвеолярного отростка челюстей можно использовать для определения эффективности лечения воспалительных изменений слизистой оболочки. Таким образом, было установлено, что измерение показателей термоасимметрии между патологическим очагом (в месте проведенной операции) и здоровой стороной может быть использовано как объективный тест с прогностической целью у больных с радикулярными кистами челюстей, т. к. характерные изменения показателей термоасимметрии (их увеличение в послеоперационном периоде) появляются на 2–3 дня раньше, чем первые клинические признаки нагноения послеоперационной раны.
Оценка гигиенического индекса Грина-Вермильона проведена у 22-х больных по схеме, предложенной Луцкой И.К. и соавт., показатели этого индекса составили 2,6±0,5 (с колебаниями от 1,7 до 2,9), т. е. гигиена полости рта оценивалась как неудовлетворительная. А у 9-ти из 22-х обследуемых (в 40,9 %) оценивалась как плохая.
Проба Шиллера-Писарева проведена у 21-го больного. Результаты были следующими: на 1 балл (окрашивания нет) – отсутствовала, на 2 балла (слабое окрашивание) – у 5 человек (23,8 %) и на 3 балла (интенсивное окрашивание) – у 16-ти человек (76,2 %).
Папиллярно-маргинально-альвеолярный индекс (РМА) составлял около 49 %, что указывало на наличие средней степени тяжести гингивита у обследуемых I группы наблюдения.
После проведения общеклинических и дополнительных методов обследования установили, что у 24-х из 29-ти обследуемых (82,8 %) больных с радикулярными кистами челюстей была выявлена гальваническая форма непереносимости сплавов металлов зубных протезов и смешанная (сочетанная) форма – у 5-ти пациентов (17,2 %).
Было установлено, что множественные радикулярные кисты челюстей, т. е. более двух кист у одного больного, выявлялись только у обследуемых с максимально повышенным (для этой группы) уровнем потенциометрических показателей (разности потенциалов – более 150 мВ, силы тока – более 10 мкА и электрической проводимости ротовой жидкости – более 10 мкСм), которые были отмечены в первые годы (1–2 года) после выполненного зубного протезирования.
Перед выполнением оперативных вмешательств (удалением радикулярных кист) проведено снятие металлических зубных протезов, которые находились в области патологического очага. На поверхности этих металлических протезов были обнаружены участки коррозии, царапины и деформации, «лысые зоны» и другие дефекты.
Проведенное обследование больных I группы наблюдения (с радикулярными кистами) подтверждает наши предположения о важной этиологической роли металлических включений в возникновении данных опухолевидных образований челюстей.
ВЫВОДЫ
На основании проведенных клинико-лабораторных и дополнительных методов обследования больных с радикулярными кистами челюстей было достоверно установлено, что наличие в полости рта несъемных металлических включений (коронок, мостовидных протезов) у данных больных создает условия для появления различных клинических форм непереносимости сплавов металлов зубных протезов. Доказано, что непереносимость сплавов металлов зубных протезов является одним из предрасполагающих факторов в возникновении радикулярных кист челюстей. Установлено, что гальваническая и смешанная (сочетанная) формы непереносимости сплавов металлов зубных протезов являются причинными факторами в возникновении одонтогенных кист.
Ранняя диагностика различных клинических форм непереносимости сплавов металлов зубных протезов и адекватное проведение лечебно-профилактических мероприятий в ранние сроки их выявления, т. е. устранение форм непереносимости сплавов зубных протезов, могут предупредить возникновение и развитие радикулярных кист челюстей.
ЛИТЕРАТУРА
Тимофеев А.А. Руководство по челюстно-лицевой хирургии и хирургической стоматологии. – Киев, 2002. – 1022 с.
Тимофеев А.А. Руководство по челюстно-лицевой хирургии и хирургической стоматологии. – Киев, 2004. – 1062 с.
Тимофеев А.А. Основы челюстно-лицевой хирургии. – Москва, 2007. – 696 с.
Hultman P., Johansson V., Tumley S.J. et al. Ad verse immunological effects and autoimmunity induced by dental amalgam and alloy in mice // FAS EBJ. – 1994. – Vol. 8, № 14. – Р.183–190.
Неспрядько В.П., Волинець В.М. Особливості перебігу симптомокомплексу нестерпності сплавів металів за даними клініко-лабораторних досліджень // Вісник стоматології. – 1997. – № 2 (14). – С. 220–224.
Онищенко В.С. Нестерпність сплавів металів зубних протезів (клініко-лабораторне дослідження): Автореф. дис. … д-ра мед. наук. – 14.00.21. – Київ. – 1995. – 43 с.
Тимофеев А.А., Горобец Е.В. Этиологическая роль металлических включений ротовой полости в возникновении предопухолевых заболеваний и опухолей челюстно-лицевой области // Современная стоматология. – 2003. – № 4 (24) – С. 86–89.
Тимофеев А.А., Горобец Е.В. Электрогальваническая характеристика тканей полости рта у больных с доброкачественными опухолями челюстей // Современная стоматология. – 2004. – № 3 (27) – С. 88–93.
Тимофеев А.А. Роль гальванического фактора в возникновении злокачественных опухолей тканей полости рта // Современная стоматология. – 2005. – № 4 (32). – С. 120–123.
Тимофеев А.А., Ушко Н.А. Некоторые аспекты патогенеза опухолей и опухолеподобных образований // В кн. «Збірник наукових праць інституту стоматології НМАПО імені П.Л. Шупика». – Київ, 2008. – Вип. 3. – С. 99–102.
Тимофеев А.А., Ушко Н.А. Роль гальванического фактора в возникновении остеогенных опухолей и опухолеподобных образований слизистой оболочки альвеолярного отростка // Современная стоматология. – 2008. – № 1 (41). – С. 150–154.
Тимофеев А.А., Ушко Н.А. Потенциометрический метод обследования больных с доброкачественными опухолями и опухолеподобными образованиями челюстей // Збірник тез «Підсумки та перспективи розвитку стоматології і щелепно-лицевої хірургії». – Харків, 2008. – С. 91–92.
Леоненко П.В. Діагностика ускладнень і прогнозування непереносності сплавів металів зубних протезів: Автореф. дис. … канд. мед. наук. – Київ. – 2005. – 20 с.
Онищенко В. С. Непереносимость сплавов металлов зубных протезов (клинико-лабораторное исследование): Дис. ... д-ра мед. наук: 14.00.22. – К., 1995. – 249 с.
Онищенко В.С. Использование сплавов для изготовления зубных протезов // Зубное протезирование. – 2002. – № 1. – С. 4–9.